如何选择BCA蛋白质定量法&Bradford蛋白质定量法? 点击:576 | 回复:0
蛋白定量BCA法,Bradford法,是2种常见的蛋白定量方法,关于这两种方法的原理,优缺点,以及操作步骤,下面将一一解析。
一、蛋白定量BCA(Bicinchoninic Acid)法
BCA (bicinchonininc acid)与二价铜离子的硫酸铜等其他试剂组成的试剂,混合一起即成为苹果绿,即BCA工作试剂。在碱性条件下,BCA与蛋白质结合时,蛋白质将Cu2+还原为Cu+,一个Cu+螯合二个BCA分子,工作试剂由原来的苹果绿形成紫色复合物,562nm处有zui高的吸收值,可在540-595nm测定其吸收值,颜色的深浅与蛋白质浓度成正比,与标准曲线对比,即可计算待测蛋白的浓度。
特点:灵敏度高,操作简单,正常情况下可在45分钟内完成测定;且试剂及其形成的颜色复合物稳定性俱佳。需要注意的是这种方法需要提前制作标准曲线。Abbkine定量总蛋白的蛋白质定量试剂盒(BCA法),线性标准曲线范围为50-1000 ug/ml,灵敏度25ug/ ml,zui低检测蛋白量达到5ug。
实验所需仪器及试剂:恒温水浴锅、可见光分光光度计、离心机、旋涡混合器、试管
操作步骤:
1.标准液制备:梯度稀释牛血清白蛋白(BSA)标准品。将8个EP管按照1到8进行标记,将BSA标准品稀释成1mg/mL工作液,准备浓度梯0,50,100,200,400,600,800,1000 ug/mL。
2.BCA工作液制备:将A液和B液摇晃混匀,按照A:B=50:1的比例配置BCA工作液,充分混匀。(BCA工作液室温下24h内稳定,故现用现配)
3.加样孵育:吸取20μL各个稀释浓度的蛋白质标准品或待测蛋白质样品,加入96孔板底部或试管中,向孔/管中再加入200uL BCA工作液轻轻摇晃混匀。在37°C下孵育30min,冷却至室温。
4.测定:冷却到室温后,以空白为对照,测量样品在562nm或该波长附近的吸光值
5.将各个标准品和待测蛋白质样品在562nm处的吸光值减去空白标准品在562nm处的平均吸光值。
浓度计算:
1.在excel表中输入对应的标准曲线值和蛋白样品值。(图中所示均为举例说明),选定标准曲线的OD值和标准品蛋白浓度。
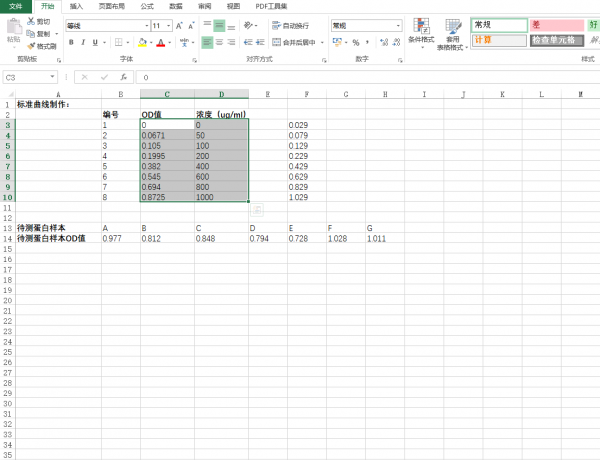
2.点击excel表栏:插入-图表-XY散点图,并点击确定。
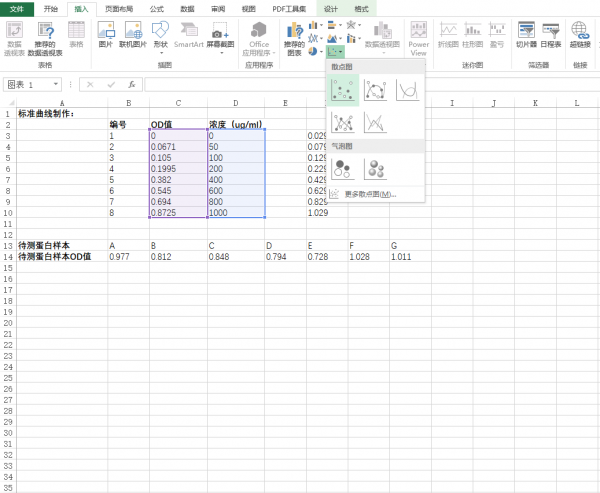
3.点击确定后会自动生成XY散点图,随意点击散点图中的任一的散点,右键添加趋势曲线。
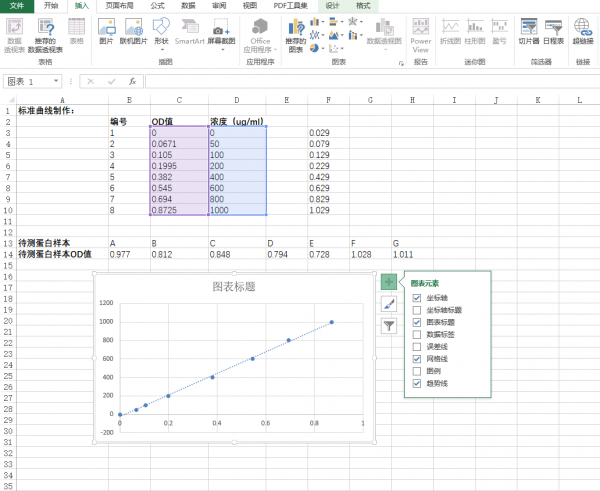
4.点击趋势线的拓展栏,选择“更多选项”
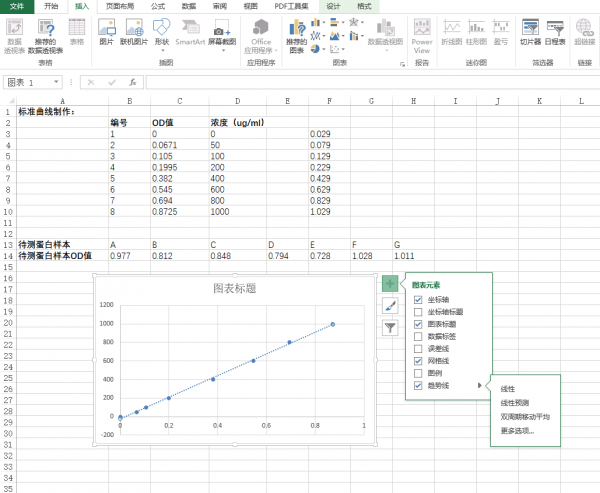
5.选择“更多选项”,弹出“设置趋势图格式”的画面,点击“显示公式(E)”以及“显示R平方值”。一般R2值越接近1,表现标准曲线做得越好,根据标准曲线带入的样品OD值测出的蛋白浓度也越准确,一般要求为0.99几左右。
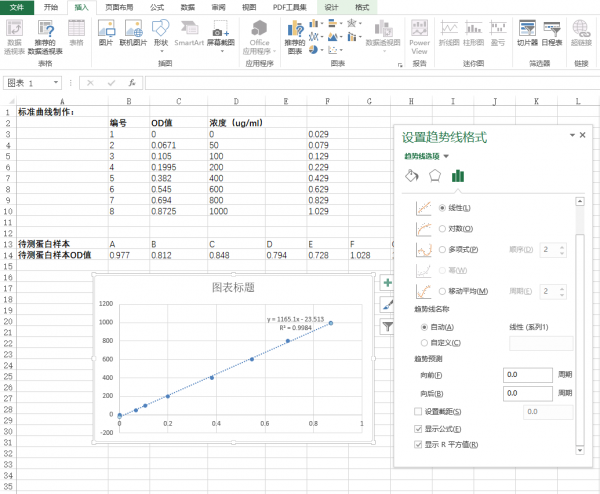
6.将样品OD值代入标准曲线的公式中,计算即得到待测样品蛋白的浓度。
考马斯亮蓝法(Bradford)
Bradford法也称作考马斯亮蓝法,是由Bradford于1976年建立的。该方法的原理是,带负电的考马斯亮蓝染料与蛋白质中碱性氨基酸相互作用。
特点:简单便捷、灵敏度高,Abbkine蛋白质定量试剂盒(Bradford法),线性标准曲线范围为50-1000 ug/ml,灵敏度25ug/ ml,zui低检测蛋白量达到5ug。反应非常灵敏,灵敏度比Lowry法还高4倍,可测定微克级蛋白质含量。Bradford 法测定蛋白浓度不受绝大部分样品中的化学物质的影响,如:K+ 、Na+ 、Mg2+离子、Tris缓冲液、糖和蔗糖、甘油、EDTA、DTT、TCEP 和β-巯基乙醇等。
需要注意的是:由于高浓度洗涤剂会影响检测结果的可靠性,必须确保样品中的SDS的浓度低于1%,Triton X-100低于0.1%,Tween 20,60,80低于0.06%,以及检测蛋白浓度的考马斯亮蓝和染色PAGE胶的考马斯亮蓝不是同一种物质,前者采用考马斯亮蓝G250,后者采用考马斯亮蓝R250,G250和R250分子基本骨架一样,但是G250多了两个甲基,与蛋白反应迅速,染胶慢且脱色困难,故用于蛋白定量;R250与蛋白反应较缓慢,染胶较快且易于洗脱,故用于PAGE胶染色。
以上两种蛋白定量方法:BCA蛋白质定量法&Bradford蛋白质定量法的使用场景,应该根据实验条件来选择,这样实验数据才会更可靠~
文章来源:Abbkine
楼主最近还看过
- 奥托尼克斯温控器参数设置说...
 [1316]
[1316] - 求高精度质量流量计或者其他...
 [618]
[618] - 工控仪表擂台第九十四期-微量...
 [1816]
[1816] - 氯气质量流量计
 [753]
[753] - 横河双频励磁流量计——AE14的...
 [615]
[615] - 伺服电动缸和气缸的区别
 [929]
[929] - (已结束)工控仪表擂台第十九...
 [3820]
[3820] - BeauGauge Suite V2 虚拟仪表...
 [1703]
[1703] - 求WP-90系列数显表参数设置说...
 [7363]
[7363] - 氯气流量测量用楔形流量计好...
 [464]
[464]

官方公众号

智造工程师
-

 客服
客服

-

 小程序
小程序

-

 公众号
公众号

















 工控网智造工程师好文精选
工控网智造工程师好文精选
