光学相干断层扫描的上皮散射自发荧光强度校正——一个模型的研究 点击:437 | 回复:0
本文以实验结合光学软件FRED来验证荧光介质上覆盖散射层的影响,结合AF-OCT系统能够减少由于上皮组织增厚引起的假阳性,增强AF疾病检测的功效。
摘要:
在本文中,我们通过模拟组织的自发荧光(AF)特性进行了模型的研究。我们组合了光学相干断层扫描(OCT)和AF成像系统,依据散射层的厚度和浓度来测量AF信号的强度。使用由生成的OCT图像计算得到的厚度和散射浓度,结合AF-OCT系统能够估计由上皮组织散射引起的AF损耗。我们定义了一个校正因子来计算上皮组织中的散射损耗,并且计算了一个校正散射AF信号。我们认为校正散射AF将会减少在早期呼吸道病变检测中的诊断误检率,误检是由混合因子产生,如增加的皮层厚度和炎症。
关键词:光学相干断层扫描;自发荧光;光散射;模型;光线光学;OCT A-line数据
1. 简介
自发荧光(AF)成像是一项已实现的技术,使用蓝光来激发自然组织荧光。通过收集高风险区域进行活检识别,已经证明这项技术对于癌症的早期检测和癌的分期是及其有效的。虽然通过白光成像可以容易的检测浸润癌,原位癌和高度的癌前病变的检测却十分棘手。白光成像中的变化十分微小,然而,AF成像可以清楚地对比这种病变。当受到蓝光照射时,正常的组织会发出强烈的绿色AF,而异常组织则缺少这种AF辐射。
尽管AF成像可以方便的检测原位癌,对于良性组织的异常现象也是十分敏感的。例如,上皮组织的厚度未必就与癌症相关,但是它确实减少了由散射产生的AF信号,导致了假阳性。因此,将癌症与其他非危险异常现象区别开来可以极大地增加治疗的疗效。
光学相干断层扫描(OCT)是可以获得生物组织皮下图像的一项相干技术,它可以提供小于10μm轴向分辨率和大约3mm穿透深度的图像。OCT采用了非电离,通常是近红外的辐射来捕获组织形态的实时图像。OCT可以用于研究高风险的组织位置。因此,当用于组合时,以一种同时和协作的形式,AF-OCT成像可以提供丰富的生化信息,并定位组织形态,这些不能通过单独的成像模式获得。比如,在上皮组织增厚的情况下,OCT可以直接测量上皮组织厚度,并且将AF信号衰减归因于上皮增厚,而不是癌症前期引起的胶原重建。因此,由OCT给定结构信息,并结合AF-OCT可以减少AF假阳性。
AF信号强度不仅取决于原位的荧光,也取决于不同组织层的光吸收和散射。组织的光散射已经经过了深入的研究1-6。模拟组织散射可以提供与AF信号强度有价值的信息。由于价格低廉、方便校准且易于获得,英脱利匹特(Intralipid)是用于组织模型最常见的散射媒介。这项工作的目的是根据散射层的厚度模拟组织自发荧光的性质。我们定义了一个AF信号校正因子,用来说明散射层引起的损耗。OCT图像给出了散射层厚度和散射颗粒的浓度,这是校正因子计算所需的两个因素。因此,我们提出了AF-OCT系统,作为癌症检测的一个更灵敏和精确的成像工具。
首先,我们解释了Intralipid模型研究,旨在模拟不同上皮厚度的组织散射特性。然后,使用光线光学仿真来验证实验结果。使用AF和OCT数据计算AF校正因子将在最后一章解释。
2. 实验步骤
我们建立了一个能够结合OCT和AF成像的双态成像系统,OCT图像测量Intralipid膜的厚度和浓度,AF图像给出相应的AF信号强度。因此,AF-OCT成像可以映射不同浓度下AF强度和Intralipid厚度的关系。
OCT光激发使用一个30mW基于多边形扫描仪的扫描波长的激光光源,具有106.8nm的带宽,中心波长为1321.4nm。 激光光源为一个基于光纤的具有参考臂和样品臂的马赫泽德干涉仪(MZI),如图1所示(OCT部分)。平衡的光电探测器(ThorLabs)检测干涉。另一个MZI单元在光源处使用,来产生样品的参考时钟。探测器输出和MZI时钟注入到数字转换器卡(AlazarTech)中,实现信号处理和创建OCT图像。
AF成像系统使用一个40mW的半导体激光器(相干),在446nm处激发荧光。使用两个1英寸直径的透镜和一个基于APD的探测器(Hamamatsu)来收集再发射的AF光子。二向色性的滤波片从AF光子中分离出后向散射的蓝光,如图1所示(AF部分)。通过在自由空间的背面抛光宽板电介质反射镜(ThorLabs),OCT和AF光信号可以实现结合和分离。电流扫描镜提供了样品AF和OCT光束共同的2维扫描。
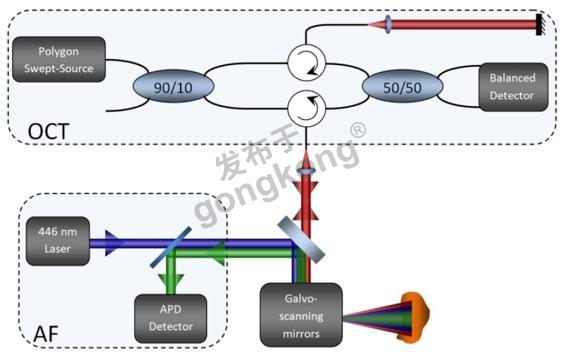
图1.AF-OCT成像系统
我们的模型,如图2(b)所示,包括一个直径为1英寸的薄(1mm高)圆柱壁,它安装在一个荧光载玻片上,以及圆柱壁中包围着的Intralipid液体。改变容器中Intralipid的量会产生不同的Intralipid膜厚度,由OCT图像测得。选择封闭的圆柱壁时,高度要低,直径要大,这样就可以得到小的Intralipid膜厚度(μm范围),同时在容器的中心区域可以接近扁平的表面以避免半月板和透镜效应。图2(a)显示了在荧光载玻片上Intralipid膜的AF信号和OCT图像。Intralipid膜的厚度和相对应的AF信号可以从图中容易地获得。
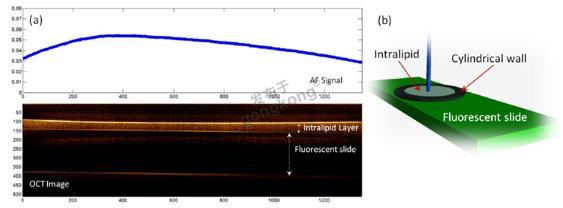
图2.(a)在荧光载玻片上Intralipid膜的AF信号和OCT图像,(b)Intralipid模型由在荧光载玻片上的圆柱壁及其中包含的Intralipid组成。
3. 光线光学仿真
使用来自Photon Engineering公司的商业软件包FRED,我们将实验的结果与光线光学仿真的结果进行比较。图3显示了仿真的配置和组件,包含一个蓝色的激光光源(446nm)、一个荧光载玻片、一个Intralipid膜、用于聚焦蓝光到样品上和收集重新发射的AF光子的1英寸透镜(焦距40mm)、一个远离透镜50cm的探测器,模仿实验的装置。探测器只对大于500nm的波长敏感,以此分离AF光子和后向散射的蓝光。
荧光载玻片由一个散射介质模拟,对于每个具有425nm–490nm波长范围的入射光子,通过散射介质的“平均自由程”后,散射介质会在随机方向重新发射一个550nm的光线。使用数量巨大的光线,重新发射光子的随机方向模仿由点光源产生的球面波,等价于荧光辐射。平均自由程决定了入射光渗透到载玻片内部的深度。Intralipid膜由具有各向异性(g)和散射系数((μs)的Henyey-Greenstein体散射模型来模拟。
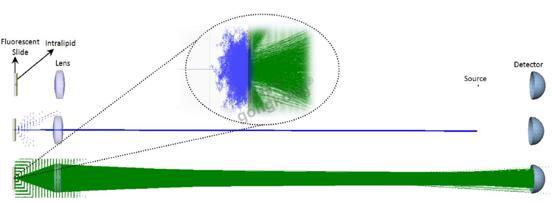
图3.包含一个荧光载玻片、一个Intralipid膜、一个1英寸透镜、一个激光光源和一个探测器的光线光学仿真装置。
4. 结果和讨论
图4(a)比较了10% Intralipid实验结果和光线光学的仿真结果。Intralipid模型仿真需要散射参数(g, μs)。散射系数7-19的理论计算和实验测量在许多论文中已经提出。然而,文献中报道的g和μs的值是变化的。我们使用在引用最多的文章中提出的数值来运行仿真,也就是van Staveren, et al8、Michels, et al17和Flock, et al19。在实验和仿真的情况下,所有的AF信号都归一化没有Intralipid膜的AF数值,来隔离Intralipid膜对AF信号的影响。使用由Flock, et al19给出的Intralipid散射参数,我们实验结果显示出与仿真结果几乎完美的匹配。然而,使用van Staveren, et al8和Michels, et al17提出的散射参数,比我们实验测量建议产生了更多的AF损耗。
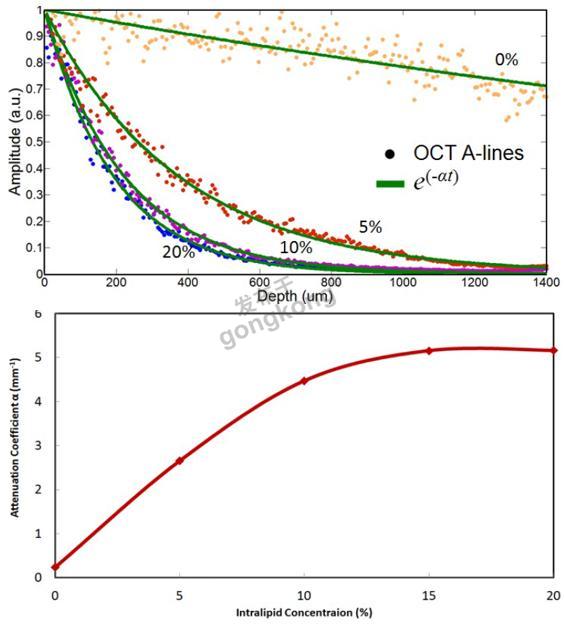
图4.(a)AF信号随Intralipid厚度变化曲线,来自实验(蓝色圆)和对10%Intralipid使用由Flock(红色方块)、van Staveren(绿色三角)和Michels(紫色方块)提出的散射参数的光线光学仿真,(b)对于不同的Intralipid浓度,实验AF信号随Intralipid厚度变化曲线。
图4(b)是对于不同的Intralipid浓度, 实验AF信号随Intralipid厚度变化曲线。正如预期,20%的Intralipid会引起激发蓝光的剧烈散射,重新发射AF会随着Intralipid厚度的增加急剧下降,然而,在较低的Intralipid浓度处,AF信号的损耗是比较少的。知道了Intralipid浓度,图4(b)记录了Intralipid膜引起的信号衰减,这可以用于AF校正因子。因此给定一个Intralipid浓度,AF信号的校正因子可以从图4(b)中估计得到。
根据事实高浓度会导致严重的信号振幅的衰减,OCT A-scan数据可以给出Intralipid浓度,然而,对于低浓度这种衰减很低。图5(上)显示了不同浓度下的OCT A-scan。A-scan数据(蓝色圆)曲线拟合到e-at函数(绿色实线),产生衰减系数(a)随Intralipid浓度的变化曲线,如图5(下)所示。OCT数据可以测量散射颗粒(图5b)的浓度,有助于找到图4中对应的曲线。举个例子,具有2.6mm-1OCT A-line损耗的样品对应于大约5%的浓度的散射颗粒。因此,AF校正因子可以由图4(b)的红色曲线确定。所以对于观察到的AF信号,AF-OCT系统提供了足够的信息来计算校正因子,从而可以用于减少较厚散射层引起的AF假阳性。
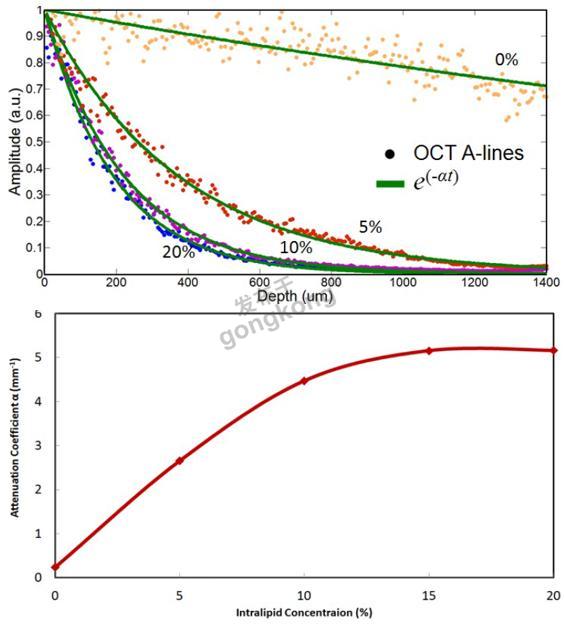
| 图5.上:OCT A-line数据(圆)曲线拟合到e-at(绿色实线),下:从OCT A-line数据得出的损耗系数a随Intralipid浓度的变化曲线。 5. 结论我们进行了一项Intralipid模型研究,使用组合的AF-OCT系统模拟了荧光介质上覆盖散射层的影响。对于不同的散射颗粒的浓度,呈现出随着散射层厚度变化的AF损耗曲线。OCT成像用于计算散射层厚度和浓度,以及估计AF信号损耗所需的参数。模型用于从散射层引起的损耗计算AF信号衰减的校正因子。因此,结合AF-OCT系统能够减少由于上皮组织增厚引起的假阳性,增强AF疾病检测的功效。 |
楼主最近还看过
- 海软化工行业地磅管理系统
 [591]
[591] - S7-300/400 梯形逻辑(LAD)编...
 [3888]
[3888] - 分析:大城市里面怎样利用风能...
 [308]
[308] - 常见的室内定位方案
 [354]
[354] - whoami
 [452]
[452] - KUROOA 光电编码器
 [1017]
[1017] - 手机卡远程无线液位控制器
 [549]
[549] - 常用±45度双线极化基站天线的...
 [366]
[366] - 常见人员定位技术解决方案特...
 [277]
[277] - 善用CRM 掌握核心客户
 [1612]
[1612]

官方公众号

智造工程师
-

 客服
客服

-

 小程序
小程序

-

 公众号
公众号

















 工控网智造工程师好文精选
工控网智造工程师好文精选
